Образования, накапливающие контрастное вещество (КВ) в артерии при компьютерной томографии (КТ) печени, могут указывать на различные патологии, включая опухоли или сосудистые аномалии. При гипоплазии печени, которая характеризуется недостаточным развитием органа, такое накопление КВ может быть связано с изменениями в васкуляризации и нарушением нормального кровоснабжения, что требует особого внимания в интерпретации изображений.
Важно учитывать, что гипоплазия печени может сопровождаться изменениями в форме и размере артерий, а также снижением функциональной активности клеток. Это может затруднить диагностику и планирование дальнейшего лечения, поэтому мультидисциплинарный подход и дополнительное исследование других методов визуализации могут быть необходимыми для более точной оценки состояния органа.
- Образования в артерии при КТ печени могут указывать на наличие патологий, связанных с гипоплазией печени.
- Гипоплазия печени характеризуется недоразвитием органа, что может влиять на кровоснабжение и вызывать аномалии в сосудистой системе.
- КТ (компьютерная томография) является важным инструментом для диагностики и выявления образований в печени и артериях.
- Образования, накапливающие контрастное вещество, могут свидетельствовать о наличии опухолей, воспалительных процессов или сосудистых аномалий.
- Важно учитывать клинические проявления и проводить дифференциальную диагностику для определения природы образований.
- Контроль и мониторинг состояния пациентов с гипоплазией печени необходимы для своевременного выявления осложнений.
Образования накапливающие кв в артерии при кт печени гипоплазия печени
а) Терминология: 1. Синонимы: • Агенезия или недоразвитие доли или сегментов печени 2. Определение: • Агенезия/недоразвитие доли или сегментов печени — это редкое нарушение развития, проявляющееся в отсутствии печеночной ткани слева или справа от области желчного пузыря без предварительных операций или заболеваний
б) Визуализация:
1. Общая характеристика: • Наилучший диагностический признак: о Отсутствие правой и левой печеночных вен, воротной вены и её ветвей, а Внутрипеченочных желчных протоков: — Если ни одна из указанных структур не отображается, то агенезия может считаться установленной • Локализация: о Наиболее часто отсутствуют следующие сегменты: — В правой доле: передние (пятый и восьмой) — В левой доле: четвертый • Размер: о Компенсаторная гипертрофия других сегментов печени

(Слева) На аксиальной КТ с контрастным усилением определяется в значительной степени уменьшенный в размерах медиальный сегмент печени, расположенный между щелью серповидной связки и желчным пузырем. Передние сегменты также уменьшены в размерах. (Справа) На аксиальной КТ с контрастным усилением в этом же случае визуализируются толстая кишка и жировая клетчатка сальника, заполняющие промежуток между правой и левой долей печени у пациента с врожденной гипоплазией переднего и медиального сегментов.
2. Компьютерная томография при отсутствии или недоразвитии сегментов печени: • Изменение соотношения органов в верхней части брюшной полости • При отсутствии правой доли: отсутствие печеночной ткани справа от междолевой щели: о Отсутствие правой печеночной вены, воротной вены и её разветвлений, а также правого внутрипеченочного желчного протока о Боковое и «глубокое» расположение желчного пузыря о Высокое положение печени в изгибе ободочной кишки; горизонтальное смещение желудка вправо о Расположение нижней полой вены близко к задней поверхности медиального сегмента левой доли печени • При отсутствии левой доли: отсутствие печени слева от междолевой щели: о Отсутствие видимости серповидной связки о Смещение желудка и селезеночного изгиба толстой кишки вверх и медиально о Высокое положение двенадцатиперстной кишки, U-образная форма желудка
3. Альтернативные методы обследования: • Холангиография: наличие или недостаточное развитие протоков в соответствующих отделах
4. Рекомендации по методам визуализации: • Оптимальный способ диагностики: о КТ (чаще всего применяемый) • Подбор протокола исследования: о КТ с контрастированием и мультипланарной реконструкцией — наилучший вариант для визуализации измененной анатомии
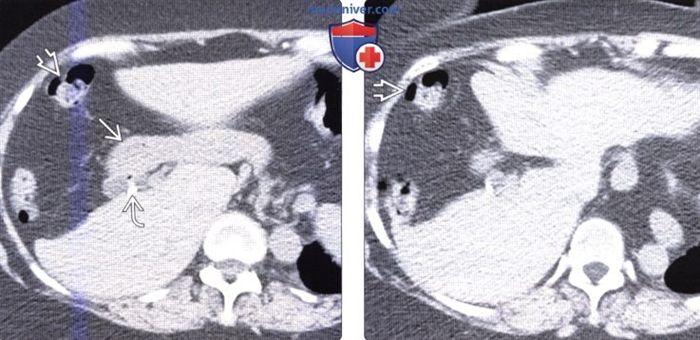
(Слева) На аксиальном КТ с контрастом обнаруживается гипоплазия переднего и медиального сегментов печени. Обратите внимание на клипсу, оставшуюся после ранее проведенной холецистэктомии (желчный пузырь обычно располагается между долями печени). Также стоит отметить грыжевое выпячивание желудка и толстой кишки в латеральном и краниальном направлениях. (Справа) На более каудальном аксиальном КТ срезе без контрастирования у этого же пациента видно свободное пространство, вызванное врожденной гипоплазией переднего и медиального сегментов печени, заполненное жировой клетчаткой сальника и печеночным изгибом ободочной кишки.
в) Дифференциальная диагностика агенезии и гипоплазии сегментов печени:
1. Цирроз печени: • Цирроз, сопровождающийся образованием очагового сливного фиброза, часто вызывает уменьшение переднего и медиального сегментов печени • Важно следить за признаками портальной гипертензии (варикозное расширение вен, асцит)
2. Период после резекции: • При выполнении резекции печени хирургический разрез может быть сделан по продольной или поперечной борозде (или по обеим)
3. Состояние после химиоэмболизации или абляции: • Атрофически измененная паренхима печени может выглядеть гипер- или гиподенсной • Необходимо проанализировать данные предыдущих лучевых исследований и изучить медицинскую документацию на предмет первичной опухоли и проводимого лечения
г) Патология:
1. Общая информация: • Этиология: о Правая доля: — Недоразвитие воротной вены или нарушения в индукции между первичной диафрагмой (septum transversum) и первичной печенью (эндодермальным дивертикулом) о Левая доля: — Закрытие венозного протока левой долевой ветви воротной вены • Ассоциированные патологические изменения: о Чаще всего — изолированная аномалия о Недостаток (гипоплазия) куполообразной части диафрагмы с этой же стороны о Отсутствие нижней полой вены о Мальротация кишечника, киста холедоха, агенезия желчного пузыря, внутрипеченочные вено-венозные шунты
2. Макроскопические и хирургические особенности: • Нетипичное увеличение других сегментов, изменение положения желчного пузыря, смещение оси щели венозной связки
д) Клинические характеристики:
1. Симптоматика: • Нарушения развития выявляются случайно во время рентгенологических исследований • Патологии билиарной системы, заворот желудка
2. Демографические данные: • Эпидемиология: о Частота проявления лобарной агенезии составляет 0,005% (по данным 19 тысяч вскрытий): — В научных источниках описано 42 случая агенезии правой доли печени
3. Течение и прогноз: • Течение обычно бессимптомное • Очень редко — образование конкрементов и развитие злокачественных опухолей билиарного тракта
4. Важно учитывать: • Состояния, такие как цирроз печени, вторичная атрофия, вызванная билиарной обструкцией, травмы и хирургические вмешательства, могут имитировать агенезию и должны быть исключены в первую очередь
е) Список использованной литературы: 1. Cho SK и др.: Ишемические повреждения печени после эмболизации печеночной артерии у пациентов с задержкой послеоперационного кровотечения после гепатобилиарных операций. Acta Radiol. 52(4):393-400, 2011
- Методы лучевой диагностики печени
- Лучевая диагностика врожденного фиброза печени
- КТ, МРТ, УЗИ при врожденном фиброзе печени
- Лучевая диагностика аутосомно-доминантного поликистоза печени
- КТ, МРТ, УЗИ при аутосомно-доминантном поликистозе печени
- Лучевая диагностика врожденного отсутствия сегментов печени
- Компьютерная томография при отсутствии и недоразвитии печеночных сегментов
- Рентгенодиагностика гнойного абсцесса печени
- КТ, МРТ и УЗИ в случае пиогенного абсцесса печени
- Радиологическая диагностика туберкулеза печени и микозов печени
Позитронно-эмиссионная томография в дифференциальной диагностике очаговых образований печени
Очаговые образования в печени являются одной из важных проблем современной лучевой диагностики в онкологии и хирургии. Особенно это актуально для пациентов, имеющих отягощенный анамнез по колоректальному раку и циррозу печени. Выживаемость больных в основном определяется наличием или отсутствием отдаленных метастазов. У большинства этих больных поражение печени является первым признаком распространенности поражения. Поэтому скрининговые обследования на предмет поиска метастазов являются предпосылкой для планирования дальнейшего лечения и наблюдения за больным.

Очаговые образования в области печени представляют собой значительную проблему в сфере современного радиологического диагностики, особенно в онкологии и хирургии. В глобальном масштабе колоректальным раком болеет от 1 до 1,2 миллиона человек ежегодно. У 50-60% пациентов со временем возникают метастазы.
Большинство пациентов (80-85%) имеют метастатические образования в печени, причем у половины из них печень является единственным органом, в который произошел метастаз. Выживаемость данной категории больных зависит от наличия или отсутствия отдаленных метастазов. У многих пациентов поражение печени становится первым признаком распространения болезни. Поэтому проведение скрининговых обследований для выявления метастатического процесса является важным шагом для планирования дальнейшего лечения и контроля за состоянием пациента.
Пациент М. Оперирован по поводу колоректального рака 1,5 года назад. При КТ и УЗИ выявлены очаговые образования печени (Рис. 1а). При ПЭТ исследовании — изолированное метастатическое поражение печени (Рис. 1б).
Подтверждена важность операционного удаления метастазов в печени, поскольку пятилетняя выживаемость пациентов, проходящих химиотерапию, не превышает 5%, а без какой-либо терапии составляет лишь 1%. В то же время, после радикальной резекции печени 35%–40% больных могут рассчитывать на продление жизни более чем на пять лет.
Для оценки возможности проведения хирургического вмешательства ключевое значение имеет предоперационная диагностика распространенности заболевания и определение злокачественности обнаруженных очагов. В рамках обследования обязательными являются компьютерная томография печени, рентгенографическое исследование легких и анализ уровня раково-эмбрионального антигена. Для выбора подходящей тактики оперативного лечения полезно выполнение компьютерной томографии печени с контрастированием печеночной артерии, так как установлено, что метастазы получают кровоснабжение преимущественно через a. hepatica, в отличие от нормальной печени, которая получает кровь через v. porta. Кроме того, интраоперационное ультразвуковое исследование печени также является важным. Нераспознанные ранее метастазы в таких случаях могут быть выявлены в 15–25% ситуаций.
У пациента В. при компьютерной томографии (Рис. 2а) обнаружено объемное образование в печени, вызывающее подозрение на метастазы. Результаты ПЭТ (Рис. 2б) подтвердили злокачественный характер этого образования и выявили метастатическое поражение лимфоузлов в области ворот печени и средостения.
Еще одной проблемой современной онкологии является развитие первичного рака печени на фоне цирроза. Вероятно, это связано с развитием новых методов, благодаря которым стало возможным диагностировать очаговые образования печени даже небольших размеров и в начальной стадии развития.
По примерным оценкам, ежегодно в мире фиксируется свыше 500000 новых случаев рака печени. Известно, что цирроз печени является «благоприятной средой» для развития гепатоцеллюлярного рака (ГЦР), и в ряде стран ГЦР, возникающий на фоне цирроза, стал одной из серьезных проблем в сфере здравоохранения. В среднем, рост опухоли до 2 см в диаметре занимает от 4 до 12 месяцев.
Приблизительно 50% узлов в цирротической печени, имеющих диаметр менее 1 см, не являются опухолевыми образованиями. Присутствие фиброза, регенераторных узлов и зон некроза создает картину гетерогенной неоднородности печени при циррозе, что затрудняет обнаружение опухолей.
Большую сложность представляет идентификация регенераторных узлов при циррозе печени, где их довольно трудно отличить от других очаговых образований печени. По данным Bolondi, Sofia, et al. (2001), ГЦР является частой причиной смерти у пациентов с циррозом печени, и любое очаговое образование печени при циррозе, прежде всего, должно наводить на мысль о ГЦР. С другой стороны важно понимать, что любое образование в печени при циррозе может выглядеть атипичным и симулировать узлы регенерации, так как последние при циррозе печени также кровоснабжаются ветвями печеночной артерии и контрастируются так же, как ГЦР. Давно изучены семиотика гепатоцеллюлярного рака, характер контрастирования опухоли, косвенные признаки, но все это, к сожалению, не позволяет с уверенностью диагностировать цирроз-рак, если размер опухоли менее 2 см, при этом ранняя диагностика ГЦР крайне важна, так как увеличивается вероятность благоприятного результата после резекции или трансплантации печени.
У пациента Г. по результатам УЗИ (Рис. 3а) было обнаружено очаговое образование в печени, которое интерпретировалось как доброкачественное. Однако, при проведении КТ с болюсным контрастированием (Рис. 3б), характеристики образования не позволяли полностью исключить возможность злокачественного процесса. В ходе ПЭТ-исследования (Рис. 3в) было выявлено объемное образование печени злокачественного характера (ГЦР).
Следующей проблемой лучевой диагностики, хирургии и онкологии являются образования печени, обнаруженные случайно. В этом случае необходима дифференциальная диагностика выявленных очагов во избежание ненужных лечебных мероприятий и хирургических вмешательств, а получение неинвазивными методами надежных характеристик образований печени стало почти так же важно, как и само обнаружение этих образований.
Пациент Д. На КТ (Рис. 4а) и УЗИ (Рис. 4б) обнаружены очаговые образования в печени неясного происхождения. ПЭТ-исследование (Рис. 4в) дало возможность исключить злокачественное новообразование. Установленный диагноз: цирроз печени.
Регенеративные узлы.
Современные методы диагностики предлагают врачам множество подходов для определения диагноза. В настоящее время позитронно-эмиссионная томография (ПЭТ) занимает всё более значимое место в диагностической практике.
Не стоит рассматривать ПЭТ изолированно от других методов исследования, поскольку, только комплексный диагностический подход может дать наиболее полную картину заболевания. Несмотря на особенности и ограничения, позитронно-эмиссионная томография заняла свое место в диагностическом алгоритме обследования пациентов, так как, являясь функциональным методом, позволяет изучать биохимические процессы организма на молекулярном уровне в томографическом режиме.
Исследования с 18F-фтордезоксиглюкозой (ФДГ) достигли значительной популярности в онкологии, так как они отображают обмен углеводов. Метод диагностики опухолей с помощью ФДГ основывается на феномене неконтролируемого увеличения использования глюкозы злокачественными клетками, что приводит к большему захвату ФДГ опухолевыми тканями по сравнению с обычными.
Увеличенный гликолиз в злокачественных опухолях напрямую связан с уровнем их злокачественности. Кроме того, такие опухоли выделяются относительно высокой активностью гексокиназы и низкой активностью фосфатазы.
Образующийся в результате биохимических реакций 18F-ФДГ-6-фосфат не вступает в дальнейшие реакции гликолиза и тем самым формируется «метаболическая ловушка», что приводит к повышенному содержанию 18F-ФДГ-6-фосфата в ткани опухоли и способствует ее выявлению. В ряде случаев методы лучевой диагностики (УЗИ, РКТ, МРТ) не позволяют однозначно интерпретировать морфологическую структуру выявленных очаговых образований в печени, особенно при циррозе.
ПЭТ предоставляет возможность оценить биологическую активность данных очагов, анализировать их изменения в процессе терапии, а Выявлять регионарное и удаленное метастазирование в организме в рамках одного исследования. Эта процедура имеет минимально инвазивный характер и требует лишь внутривенного введения, что позволяет безболезненно обнаружить злокачественные новообразования.
Мы провели исследование на 90 пациентах с очаговыми поражениями печени. Компьютерная томография осуществлялась на оборудовании «Somatom Plus 4» компании Siemens в спиральном режиме с использованием болюсного контрастного усиления. У всех обследованных были обнаружены очаговые образования различной формы и размера в печени, которые в той или иной степени накапливали контрастный раствор в артериальную и последующие фазы контрастирования.
УЗИ брюшной полости проводилось на аппарате «Sonoline Elegra» фирмы Siemens датчиком 3,5 MHz. На УЗИ было подтверждено наличие объемных образований в печени у 94% пациентов. У 6% пациентов очаговых изменений паренхимы печени выявлено не было. ПЭТ обследование осуществлялось на томографе «ECAT EXACT 47» фирмы Siemens с использованием 18F-ФДГ.
Сканирование выполнили в статическом режиме по протоколу Whole body в 2D формате. Обработка данных включала визуальную интерпретацию изображения "всего тела" пациента, а также оценку коэффициента дифференциального накопления ФДГ в обнаруженных областях. В результате у 37% пациентов не было выявлено очагов с повышенным захватом ФДГ в печени.
Во время последующего гистологического анализа у пациентов подтвердился диагноз цирроза. У 6% пациентов были обнаружены очаги гиперфиксации ФДГ, не отображавшиеся на УЗИ, и имеющие парадоксальные изменения характеристик при КТ. При гистологическом изучении у этой группы пациентов был установлен диагноз гепатоцеллюлярного рака.
У 54% испытуемых в печеночной ткани наблюдались участки с высоким уровнем накопления ФДГ, которые соответствовали объемным образованиям, обнаруженным с помощью КТ и УЗИ по размеру и расположению. При этом в 44% случаев, помимо участков гиперфиксации в печени, были зафиксированы также множественные внепеченочные очаги с повышенным накоплением препарата, свидетельствующие о генерализации опухолевого процесса.
У 3% изолированные очаги гиперфиксации ФДГ при ПЭТ определялись в печени, количественно больше чем при КТ и УЗИ исследованиях. Количество очагов, их расположение и отсутствие накопления ФДГ в регионарных лимфоузлах и других органах позволило провести хирургическое лечение с последующим гистологическим исследованием, при котором было подтверждено количество выявленных очагов и их метастатическая природа.
В итоге, позитронно-эмиссионная томография зарекомендовала себя как эффективный способ для обнаружения метастазов в печени и их дифференциации от доброкачественных образований. ПЭТ способствует выявлению метастазов за пределами печени, что может изменить стадию заболевания и уточнить подход к терапии и хирургическим интервенциям. Этот метод обеспечивает неинвазивную оценку степени вовлеченности печени и других органов в рамках одного исследования, что существенно ускоряет процесс диагностики. Использование ПЭТ является обязательным для диагностики у пациентов с очаговыми образованиями печени, несмотря на высокую стоимость процедуры.
Радкевич Л.А., Зубанов А.Г., Родченко З.П., Зайцева А.Ю.
Параметры объёмных образований на КТ
Очаговые поражения печени, обнаруженные с помощью компьютерной томографии, делят в зависимости от таких характеристик:
- Плотность образований. В зависимости от радиоденсивности (рентгеновской плотности) различают несколько типов образований: гипо-, гипер- и изоденсивные (по плотности равные) относительно окружающей нормальной ткани. На основании этого параметра специалист делает предположение о составе очага: это может быть жидкость (например, кровь), мягкие ткани или кальцинаты (кальциевые соли).
- Структура. Кисты могут состоять из одной или нескольких камер и могут или не могут иметь стенку. В образовании могут присутствовать кальциевые соли, гиперденсные или гиподенсные жидкости (например, желчь). Внутри может находиться инородное тело, паразит, кистозные образования или мягкие ткани. Их структура может быть однородной или иметь участки некроза. Присутствие извести и солей кальция указывает на хронический процесс.
- Форма. Образования могут быть шаровидными, удлинёнными или неправильно сформированными.
- Контуры могут быть как ровными, так и неровными, четкими или размытыми.
- Габариты. Специалисты устанавливают линейные размеры образования (длина и ширина) при анализе поперечного среза. Если предполагается проведение контрольной КТ, выбирается «маркерный очаг», величину которого будут вычислять впоследствии.
- Локализация. Образование может находиться в глубине печени, под капсулой, вблизи крупных сосудов, желчного пузыря (ЖП) или его протоков и т. д. Этот аспект позволяет определить его происхождение; к примеру, билиарные опухоли располагаются рядом с ЖП или его путями.
- Количество. Образования могут быть единичными или множественными (например, метастазы при опухолях органов пищеварения).
- Сбор контраста. Низкое накопление контрастного вещества в очаге свидетельствует о неразвившейся сосудистой сети. Быстрое накопление контрастного вещества указывает на хорошее кровоснабжение. Если плотность быстро снижается после завершения введения контрастного средства, это может означать высокий уровень кровотока в поврежденной зоне.
Гемангиома на компьютерной томографии без контраста проявляется как область с пониженной плотностью, что затрудняет определение её природы. В артериальную фазу контрастирования плотность гемангиомы увеличивается, так как кровь заполняет сосудистые лакуны. Впоследствии плотность возвращается к исходным уровням, что позволяет врачу различить доброкачественное образование и злокачественную опухоль. Злокачественные образования на КТ с контрастом выглядят как плотные кольца или ободки.
Образования доброкачественного характера
Среди типов можно выделить такие доброкачественные образования:
Печеночная киста
Это очаговое образование печени имеет разное происхождение: врождённое, приобретённое, воспалительное, паразитарное. На вид это капсула, наполненная жидкостью. Реже наблюдаются опухоли с желеобразной структурой зеленовато-коричневого оттенка. Они могут размещаться на поверхности органа или внутри.
Кисты имеют разнообразные размеры, их диаметр варьируется от нескольких миллиметров до 25 см. Когда такие образования образуются на всех участках печени, это указывает на поликистоз.

Желчная киста в печени
Аденома
Необычное образование доброкачественного типа. Существует два вида: печёночно-клеточная аденома и цистаденома. Первая образована клетками, которые схожи с гепатоцитами, тогда как вторая включает в себя маленькие пролиферирующие желчные пути, выстланные эпителиальной тканью с содержанием слизи. Из-за различий в строении для обнаружения аденомы назначают биопсию.
На вид это ограниченные узлы, диаметр которых от 1 до 20 см. При аденомах назначают операцию, так как существует вероятность её разрыва, повреждения сосудов и кровоизлияния.
Гемангиома правой доли железы
Данное явление довольно часто встречается. Обычно гемангиомы выявляются случайным образом при проведении УЗИ или КТ-исследований. Эти новообразования способны сжимать желчные протоки и сосуды, могут разрываться, вызывая интенсивное кровоизлияние, или перерастать в злокачественные опухоли. Лечение пациента с таким образованием осуществляется в условиях стационара.
Липома (жировик)
Бенигненное образование, возникшее из жировой ткани. Размеры его очагов обычно не превышают 5 см. Для диагностики липомы эффективно используется компьютерная томография.
Гиперплазия
Является доброкачественным образованием без капсулы. Оно состоит из клеток соединительной ткани, желчных путей и печени. Это множественные узлы, размер которых от 0,1 до 4 см располагаются в основном в правой доле железы. Тогда гиперплазия имеет неоднородное строение и разные эхопризнаки. Чтобы выявить очаги, назначают КТ с контрастом или МРТ.
Гамартома (тератома)
Это новообразование возникает из-за неправильного развития эмбриона. Как правило, тератомы располагаются под оболочкой печени.
Билиарная цистаденома
Это является неопасным образованием, находящимся в желчных протоках. Это подлинная киста с множеством камер, и её стенки состоят из эпителиальной ткани, которая производит муцин (высокомолекулярный гликопротеин).
Доброкачественные образования не проявляются характерными симптомами, поэтому их выявляют случайно во время УЗИ или КТ. При наличии крупных опухолей возникает дискомфорт и боль справа под рёбрами.
При выявлении новообразования у пациента необходимо регулярно посещать онколога. Обширные кисты устраняются хирургически с удалением затронутой части железы.
Доброкачественные опухоли редко переходят в злокачественные формы.
Современные достижения в лучевой диагностике гепатоцеллюлярного рака

Таким образом, использование гадоксетовой кислоты позволяет оценить степень контрастирования ГЦР в зависимости от дифференцировки опухоли: хорошо дифференцированный ГЦР, благодаря наличию активных гепатоцитов, способен проявлять специфическое поглощение контрастного средства, тогда как средне- и слабодифференцированный ГЦР демонстрирует либо слабое, либо вовсе отсутствующее специфическое поглощение контрастного препарата. Это может помочь в предварительной оценке степени дифференцировки рака до проведения гистологического анализа. Следует подчеркнуть, что исследования в этой перспективной области проводятся во многих странах, однако важно более активно применять данное контрастное вещество для накопления отечественного опыта.

Тонкоигольная биопсия
- Fong Y и др.: DeVita VT Jr., Hellman S., Rosenberg SA (Ред.). Онкология: Принципы и практика. 6-е изд. Филадельфия: Lippincott Williams 2001:1162-203.
- http://www.nlm.nlm.gov/medlineplus/ency/imagepage/1102.htm
МРТ или КТ?
По своей информативности МРТ сопоставимо с КТ с использованием контрастного вещества для исследования печени. К выбору КТ прибегают в случаях, когда есть противопоказания для МРТ, например, наличие металлических протезов, кардиостимуляторов или имплантатов.
Цена за КТ печени без контрастирования составляет 2450 рублей, в прейскуранте это исследование указано как КТ брюшной полости. КТ с внедрением контраста будет стоить больше, поскольку дополнительно оплачивается контрастное средство Ультравист по цене 2700 рублей за 100 мл. Расход контрастного вещества зависит от веса пациента. В диагностическом центре СПб «Магнит» стоимость МРТ печени составляет 6300 рублей.
Длительность диагностики – до 30 минут. Результаты можно получить лично через 2 часа после исследования, при этом врач консультант подробно разъяснит результаты исследования и даст свои рекомендации. Также электронная версия по просьбе клиента отправляется на почту. Все исследования сохраняются, поэтому в любое время можно будет запросить результаты.
Диагностика нодулярной гиперплазии печени
Консультация у гастроэнтеролога обычно позволяет выявить неспецифические проявления заболевания: диспепсию, а также легкие боли. При физикальном обследовании можно пальпировать опухоль значительных размеров, а при нарушении оттока желчи у пациента наблюдается желтуха кожи и склер. Лабораторные исследования, как правило, не обнаруживают специфических признаков нодулярной гиперплазии печени. В редких случаях фиксируется небольшое повышение уровня аланинаминотрансферазы и билирубина. Для дифференциальной диагностики с злокачественными опухолями печени обязательно проводится исследование онкомаркеров: альфа-фетопротеина, СА 19-9, СЕА.
Для диагностики нодулярной гиперплазии печени применяются различные инструментальные методы. Основным признаком этой патологии считается «звездчатый шрам» в центре образованного образования, однако он не наблюдается у всех пациентов и может Встречаться при фиброламеллярной карциноме, внутрипеченочной холангиокарциноме и других недугах. Данное ограничение в диагностике касается всех методов визуализации: УЗИ печени, КТ и МРТ органов. При ультразвуковом исследовании органов брюшной полости единственным признаком нодулярной гиперплазии печени может выступать смещение сосудов, иногда выявляется гипоэхогенный край опухоли (сдавленные сосуды и паренхима). Более информативным является исследование в режиме допплеровского сканирования, где можно увидеть гипертрофированную центральную артерию.
При проведении компьютерной томографии выявляется хорошо отграниченное образование, накопление контрастного вещества в области гиперплазии. МРТ дает аналогичные результаты: гиперинтенсивность контрастирования в артериальную фазу и гипоинтенсивность – в венозную. Неинвазивные методики обладают специфичностью только при классическом типе нодулярной гиперплазии печени. Высокой информативностью при проведении дифференциальной диагностики с другими гиперваскулярными образованиями обладает сцинтиграфия печени. В затруднительных случаях может быть выполнена ангиография, но данный метод также неспецифичен.
Если установить диагноз не удается с помощью неинвазивных методов исследования, то применяют биопсию. Основными критериями для диагностики являются наличие толстостенных сосудов, фиброзной ткани, пролиферирующих протоков и узловой формы опухоли. Дополнительные критерии включают перисинусоидальный фиброз и дилатацию синусоидов. Диагноз считается достоверным при выявлении трех главных критериев, вероятным – если наблюдаются два основных и 1-2 дополнительных.
Для дифференциальной диагностики нодулярной гиперплазии необходимо учитывать другие доброкачественные и злокачественные опухоли печени, крупноузловой цирроз, а также регенеративную гиперплазию при болезнях соединительной ткани.
Лечение и прогноз нодулярной гиперплазии печени
Чаще всего лечение нодулярной гиперплазии печени не является необходимым. Если опухоль не увеличилась до значительных размеров, не оказывает давления на близлежащие органы и не стремится к росту, главной задачей становится устранение причины (если она известна). Прекращение приема гормональных контрацептивов или уменьшение дозы системных глюкокортикостероидов может быть достаточным для уменьшения размеров образования и его полного исчезновения. Тем не менее, пациент обязан регулярно проходить обследования для контроля за размерами опухоли и своевременного выявления показаний для хирургического вмешательства.
Если нодулярная гиперплазия печени крупная, нарушает отток желчи, препятствует кровообращению или сдавливает соседние органы, проводится энуклеация опухоли или сегментарная резекция печени. Оперативное лечение также требуется в случаях, когда диагноз окончательно не установлен, и опухоль имеет тенденцию к увеличению (в такой ситуации удаление образования проводится даже при нормальных результатах биопсии).
Прогноз при нодулярной гиперплазии печени является положительным. На протяжении длительного времени заболевание может не вызывать никаких симптомов у пациента, а осложнения возникают весьма редко. Специальных мер профилактики не предусмотрено. Важно обоснованное применение гормональных средств, а после подтверждения диагноза обязательно следует регулярно проводить УЗИ печени для контроля за развитием заболевания.
