При некрозе печеночной паренхимы наблюдается повышение уровня определенных ферментов, таких как аланиновая аминокислота (АЛТ) и аспартатаминотрансфераза (АСТ). Эти ферменты обычно содержатся в клетках печени и при их повреждении попадают в кровь, что и приводит к увеличению их уровней в анализах.
Кроме того, уровень щелочной фосфатазы и гамма-глутамилтрансферазы (ГГТ) также может повышаться, но они менее специфичны к поражению печени. Важно учитывать, что увеличение этих ферментов должно рассматриваться в контексте других клинических данных для более точной диагностики и оценки состояния печени.
- Некроз печеночной паренхимы приводит к выделению специфических ферментов в кровь.
- Главные ферменты, уровень которых увеличивается при некрозе:
- Аланинаминотрансфераза (АЛТ)
- Аспартатаминотрансфераза (АСТ)
- Лактатдегидрогеназа (ЛДГ)
- Увеличение этих ферментов связано с разрушением клеток печени и высвобождением их в кровоток.
- Анализ концентрации ферментов помогает в диагностике острых и хронических заболеваний печени.
- Повышенные уровни могут свидетельствовать о серьезных патологиях, таких как гепатит, цирроз или печеночная недостаточность.
Некроз печени
Некроз печени — это заболевание, которое связано с разрушением клеток печени (гепатоцитов). Уничтожение клеток может происходить под влиянием различных факторов повреждения, таких как механические, температурные, химические или токсичные, а также из-за прекращения кровоснабжения органа. Рассмотрим проявления этого заболевания, возможность остановки патологического процесса и предотвращения осложнений.
Нарушение кровоснабжения печени, которое может быть вызвано серьезными заболеваниями или внешними воздействиями, приводит к деградации клеток печени.
Процесс гибели гепатоцитов проходит в два этапа. Первый этап (некробиоз) связан с отмиранием клеток, тогда как второй (собственно некроз или аутолиз) характеризуется распадом погибших гепатоцитов. Гибель клеток происходит локально, образуя четко очерченный некротический фокус с разрушенной паренхимой внутри и рубцовой тканью снаружи.
Причины
Некроз развивается под воздействием различных внешних и внутренних факторов. Специалисты выделяют следующие наиболее распространенные причины разрушения гепатоцитов:
- хронические вирусные гепатиты, алкогольное повреждение печени;
- обостряющийся цирроз;
- врожденные и приобретенные заболевания, связанные с нарушением обмена веществ и функционированием эндокринных органов (синдром Вильсона, гемохроматоз, диабет, стеатогепатит, лишний вес, тиреотоксикоз);
- аутоиммунные заболевания, включая ревматизм;
- геморрагические лихорадки;
- инфекционные (возвратный тиф, лептоспироз) и паразитарные (фасциолез, эхинококкоз) заболевания;
- серьезные сердечно-сосудистые заболевания, связанные с нарушением кровообращения (длительное нарушение кровоснабжения ведет к ишемии печеночных тканей);
- интоксикация через наркотические вещества (кокаин, экстази), токсиноподобные соединения (например, ядовитые грибы) или гепатотоксичные медикаменты (Аспирин, Парацетамол, Амиодарон, Ниацин, препараты группы ацетаминофенов, метотрексатов, изониазидов);
- воздействие радиации или высоких температур;
- значительные травмы органа;
- гемобластозы (раковые опухоли), гепатоцеллюлярная карцинома.
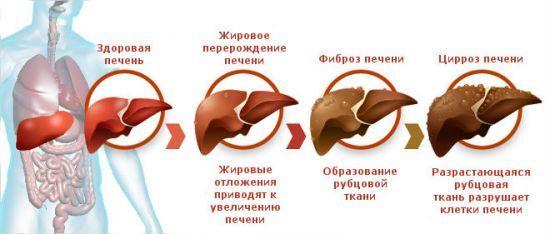
Некроз чаще всего проявляется как опасное последствие разных заболеваний печени и возникает из-за проблем с печеночным кровообращением, травм или интоксикаций.
Какие феpменты увеличиваются только пpи некpозе печеночной паpенхимы
Печеночно-клеточная недостаточность развивается при значительном некрозе паренхимы печени, вызванном вирусным гепатитом, острыми отравлениями гепатотоксичными веществами, перевязкой печеночной артерии вблизи органа, а также при хроническом холестазе, что приводит к серьезным нарушениям гомеостатических и барьерных функций печени.
Прогрессирующий некроз печени сопровождается быстрое уменьшение ее размеров, что известно как синдром "таяния печени": печень становится мягкой, рыхлой, нижний край перестает прощупываться, а зона печеночной тупости уменьшается и исчезает.
В организме происходит накопление значительного числа церебротоксичных соединений, что приводит к нарушению энергетического барьера и нарушению передачи нервных сигналов. Формируются ложные нейромедиаторы, в том числе серотонин, а угнетение глюконеогенеза ведет к гипогликемии. Метаболический ацидоз, возникающий из-за накопления молочной и пировиноградной кислот (что вызывает нарушение проницаемости клеточных мембран и отек мозга), способствует гипервентиляции и респираторному алкалозу, который, в свою очередь, негативно сказывается на мозговом кровообращении, усиливая гипоксию мозговой ткани.
Диагноз отека мозга устанавливается клинически по наличию признаков раздражения мозговых оболочек, гиперемии и потливости лица, судорожных подергиваний, глазодвигательных расстройств, прогрессирующих нарушений дыхания, артериальной гипертензии.
При печеночно-клеточной недостаточности наблюдается снижение уровня прокоагулянтов (протромбин, фибриноген), холестеразы, холестерина и альбумина в сыворотке крови. Уменьшение каждого из этих показателей можно рассматривать как признак гепатодепрессии.
Выраженная гипербилирубинемия, в основном из-за увеличения конъюгированной формы билирубина, также характерна для данного состояния. Желтуха свидетельствует о степени повреждения гепатоцитов и указывает на возможный неблагоприятный прогноз.

Биохимическим показателем цитолиза является повышенная активность аминотрансфераз, которая достигает максимальных значений при быстром разрушении печеночной ткани. Превышение уровня АсАТ относительно АлАТ считается негативным индикатором.
Наблюдаются гипермия конечностей, нестабильный пульс и капиллярная пульсация. Увеличивается сердечный выброс, что проявляется клинически в виде тахикардии, усиленного сердечного толчка и систолического шума. Артериальная гипотензия усугубляет нарушение кровотока в печени, что может привести к развитию острого почечного недоразумения и ухудшению психического состояния. Интересно, что использование адреномиметиков для коррекции артериальной гипотензии дает лишь временные результаты.
Периферическое сосудистое сопротивление снижается, артериовенозная разница по кислороду и доставка кислорода уменьшаются. Вазодилатация при печеночной недостаточности способствует усилению гипоксии тканей.
Снижение общего циркулирующего объема крови в результате дилятации артериол под влиянием оксида азота активирует симпатоадреналовую и ренин-альдостероновую системы, что приводит к задержке натрия и жидкости, способствующей развитию асцита. Клинически значимо резкое уменьшение уровня РаO2, которое обычно наблюдается за день до наступления комы.
При обширном некрозе печени кома, возникающая в первые дни заболевания, отличается особой быстротой прогрессирования. Этот тип печеночной недостаточности называется фульминантным.
Наиболее яркими проявлениями печеночной недостаточности являются "печеночный" запах изо рта, желтуха, уменьшение размера печени, склонность к кровоточивости и нарастающие признаки энцефалопатии.
Запах, напоминающий печень, можно сопоставить с ароматом только что вскрытого тела или с запахом мышей. В случае острого поражения печени этот"e; печеночный"e; запах, наполняющий всю палату, в которой находится пациент, считается предвестником коматозного состояния.
Желтуха у больных с острой печеночной недостаточностью, как правило, бьюает интенсивной, особенно в период развития комы. На коже лица могут появляться малиново-красные сливающиеся пятна, причем их интенсивность зачастую коррелирует с тяжестью комы.
Геморрагический синдром проявляется в виде кровоизлияний на склерах, под кожей в области локтевых сгибов, на голенях и ягодицах. Кровоизлияния также могут происходить в зонах инъекций. Носовые кровотечения встречаются достаточно редко.
Состояния, угрожающие жизни, которые связаны с потерей крови, нарушением баланса электролитов, а также применением седативных средств и наркотических обезболивающих, могут способствовать ухудшению печеночной энцефалопатии и развитию комы.
Биохимические функциональные печеночные пробы
Применяются для оценки функционального состояния печени и дифференциации различных типов ее поражений (воспалительного, инфильтративного, метаболического, сосудистого, гепатобилиарного) (табл. 223).
Билирубин. Позволяет оценить поглотительные, метаболические (конъюгация) и экскреторные функции печени; конъюгированную фракцию (прямую) можно отличить от неконъюгированной с помощью биохимического анализа (см. табл. 221).
Аминотрансферазы. Аспартатаминотрансфераза (АсАТ) и аланинаминотрансфераза (АлАТ) * выступают чувствительными индикаторами состояния клеток печени, их уровень значительно повышается при некрозе клеток печени (вирусный гепатит, токсические поражения печени, циркуляторный коллапс, острая обструкция печеночных вен), а также иногда при резкой обструкции желчных путей (например, камнем); активность аминотрансфераз слабо связана с тяжестью заболевания; менее выраженные отклонения наблюдаются при холестатических, цирротических и инфильтративных процессах; АлАТ более специфична для печеночной патологии, в то время как АсАТ также присутствует в скелетных мышцах; при алкогольных повреждениях печени наблюдается умеренное увеличение уровня АсАТ, которое, как правило, превышает уровень АлАТ.
Лактатдегидрогеназа (ЛДГ). ** Это менее специфичный индикатор состояния клеток печени, который имеет ограниченную ценность для диагностики печеночных поражений.
Щелочная фосфатаза (ЩФ). *** Это чувствительный маркер холестаза и обструкции желчных путей (увеличивается быстрее, чем билирубин в сыворотке), а также инфильтрации печени; но её специфичность невысока из-за широкой распространенности в других тканях. Уровень ЩФ в крови значительно повышен у детей, во время беременности и при заболеваниях костей; специфические тканевые изоферменты можно различать по термостабильности (печеночные ферменты остаются активными в условиях, когда активность костных ферментов значительно снижается).
- * Аспартатаминотрансфераза и аланинаминотрансфераза. При остром полном закрытии желчных путей значения могут возрастать быстро и резко, однако уже через 13 дней, даже при продолжающейся обструкции, они снижаются почти до нормальных уровней.
- ** Может наблюдаться увеличение при сохранении билиарной обструкции и вторичном билиарном циррозе.
- *** Может уменьшаться при продолжающейся билиарной обструкции и вторичном билиарном циррозе. Обозначения: N — норма, t — повышено, I — понижено.
Таблица 223 Изменения печеночных проб
Инструментальные методы исследования гепатобилиарной системы
Ультразвуковое обследование (УЗИ) является быстрым и безболезненным методом диагностики органов брюшной полости. Этот метод сравнительно экономичен, а оборудование при этом имеет портативный формат. Точность интерпретации полученных данных во многом зависит от опыта врача. УЗИ особенно эффективно для обнаружения расширения желчных путей и камней в желчном пузыре (с точностью более 95 %), хотя его чувствительность к камням в желчных протоках составляет около 40 %. Метод обладает высокой чувствительностью для диагностики асцита и умеренно эффективен при оценке внутрипеченочных образований, демонстрируя отличные результаты при дифференциации плотных и кистозных образований. Он также полезен для выполнения чрескожной пункционной биопсии неопределенных поражений печени. Допплеровское ультразвуковое исследование позволяет выявить наличие и объем кровотока в воротной и печеночных венах, а В портосистемных шунтах. Визуализация ухудшается в условиях наличия кишечного газа, но значительно улучшается при асците. Эндоскопическая ультразвуковая методика менее подвержена влиянию кишечного газа и помогает определить степень прорастания опухолей в стенку кишечника.
Компьютерная томография (КТ) является высокоэффективным методом для диагностики, различения и выполнения чрескожной пункционной биопсии тканей в области брюшной полости, кист и участков с лимфаденопатией. Качество изображений улучшает внутривенное или внутрикишечное контрастирование, тогда как наличие кишечного газа может ухудшать их четкость. Этот метод имеет меньшую чувствительность по сравнению с УЗИ для обнаружения камней в желчном пузыре при холедохолитиазе и может применяться при некоторых диффузных болезнях печени, таких как жирная инфильтрация и перегрузка железом.
Магнитнорезонансная томография (МРТ) наиболее чувствительна в диагностике поражения печеночной ткани и кист; позволяет отличать гемангиомы от опухолей печени; очень точный неинвазивный метод оценки проходимости печеночных И воротной вен, сосудистых нарушений при росте опухоли; полезен для мониторирования отложений железа и меди в печени (гемохроматоз, болезнь Вильсона).
Радионуклидное сканирование. Определенные методы сканирования с высокой чувствительностью позволяют оценивать выделение желчи (HID A, PIPIDA, DISIDA), изменения в тканях печени (например, технеций серный коллоидный для сканирования печени или селезенки), а Воспалительные и опухолевые заболевания (сканирование с использованием галлия); метод HIDA и другие эффективны для оценки проходимости желчных путей и исключения острого холецистита. Сканирование с коллоидом, КТ и МРТ имеют одинаковую чувствительность в выявлении опухолей и метастазов печени; коллоидное сканирование дает возможность точно определить размеры селезенки и достаточно достоверно установить признаки цирроза и портальной гипертензии; комбинированное сканирование с коллоидом печени и легкого чувствительно для оценки поддиафрагмального (надпеченочного) абсцесса.
Холангиография — это самый чувствительный метод для обнаружения камней, новообразований в желчных протоках, склерозирующего холангита, кист общего желчного протока, свищей и прочих повреждений желчевыводящих путей. Процедура может быть осуществлена как эндоскопически, так и чрескожно (через печеночные ткани), что позволяет получить образцы желчи и эпителиальных клеток желчных путей для дальнейшего цитологического и культурального анализа. Также данный метод предоставляет возможность для введения катетера, с целью дренирования желчи, расширения стриктур и растворения желчных камней. Эндоскопический подход позволяет провести манометрию сфинктера Одди, сфинктеротомию и удалить камень.
Ангиография представляет собой наиболее надежный способ измерения давления в портальной системе и анализа состояния кровотока в воротной и печеночных венах. Этот метод обладает высокой чувствительностью к обнаружению мелких сосудистых изменений и новообразований печени, особенно при первичной карциноме. Он считается «золотым стандартом» в дифференциации плотных опухолей от гемангиом. Также ангиография является самым эффективным методом для изучения сосудистой анатомии, что необходимо для планирования сложных гепатобилиарных операций, таких как портосистемное шунтирование и реконструкция желчных протоков, а также для оценки возможности удаления опухолей, исходящих из гепатобилиарной системы и поджелудочной железы.
Причины высокого уровеня печеночных ферментов
Существует множество заболеваний и состояний, которые могут привести к увеличению активности печеночных ферментов. Врач-диетолог выясняет причину, анализируя принимаемые медикаменты, проявляющиеся симптомы, а также, в ряде случаев, дополнительные анализы и процедуры. Наиболее частыми факторами, способствующими повышению уровня ферментов печени, являются:
- безрецептурные болеутоляющие средства, особенно парацетамол
- определенные рецептурные медикаменты, включая статины, предназначенные для контроля показателей холестерина
- употребление алкогольных напитков
- сердечная недостаточность
- вирусные гепатиты А, В и С
- неалкогольная жировая болезнь печени
- ожирение.
Другие возможные источники повышения уровня ферментов печени включают:
- алкогольный гепатит
- аутоиммунный гепатит
- целиакия
- инфекция, вызванная цитомегаловирусом
- вирус Эпштейна-Барра
- гемохроматоз
- раковая опухоль печени
- мононуклеоз
- полимиозит
- септический шок
- проблемы с щитовидной железой
- токсический гепатит
- болезнь Вильсона
Как диагностируется повышенный уровень печеночных ферментов
Врач терапевт может рекомендовать провести клинический анализ крови и проверку функции печени, а при необходимости предложит сделать УЗИ печени.
Патогенез (что происходит?) во время Некроза печени:
По степени затрагиваемой ткани печени некрозы классифицируются на:
- фокальные (частичные);
- моноцеллюлярные, локальные или рассеянные;
- зональные;
- ацинарные;
- субмассивные или массивные.
Гепатоциты могут демонстрировать коагуляционный, колликвационный (цитолиз) некроз и инфаркты.
Это наблюдается в клетках печени, богатых белком. Данный процесс связывают с проникновением в ткань кальциевых ионов и активацией различных ферментов. Некроз может быть частичным (фокальным) или тотальным (охватывающим всю цитоплазму). При частичном некрозе обнаруживаются гомогенные округлые образования — тельца Мэллори. Тотальный некроз проявляется уплотнением и сжатием всего гепатоцита, что приводит к образованию гомогенных структур — ацидофильных телец Каунсилмена.
Чаще встречается в гепатоцитах, относительно бедных белком и богатых протеазами. При этом клетки увеличиваются в размерах, не воспринимают красители, не содержат ядро и кажутся оптически пустыми.
Согласно степени выраженности и локализации в печеночной дольке выделяют следующие виды некроза:
- фокальный (некроз одного или более близко расположенных гепатоцитов — острые и хронические вирусные гепатиты, ЦП);
- зонально-центролобулярный (хронические гепатиты, токсическое воздействие на печень со стороны гепатогенных веществ, piecemeal ("ступенчатый" некроз) при отравлении гепатотоксинами через рот);
- субмассивный и массивный (некроз почти всей паренхимы печеночной дольки, что приводит к развитию печеночной комы).
В зонах некроза наблюдается разрушение ретикулиновой стромы печени. На периферии этих очагов происходят реактивные и репаративные процессы: миграция лейкоцитов из сосудов, пролиферация мезенхимальных клеток и накопление небольшого количества макрофагов.
Удары наносятся на участки печеночных клеток, особенно на определенную группу органелл, что приводит к образованию аутофагосом и денатурации белков. При коагуляционном некрозе наблюдаются тельца Маллори, а при колликвационном — баллонная дистрофия. Апоптоз представляет собой особый вид некроза, в процессе которого гепатоциты проходят "самоуничтожение", уменьшаются в размере и распадаются на конденсированные клеточные фрагменты, заполненные органеллами. Эти отделившиеся фрагменты поглощаются макрофагами или другими гепатоцитами.
- Моноцеллюлярные некрозы (могут быть как рассеянными, так и очаговыми)
Чаще всего такие изменения наблюдаются при остром (вирусном и медикаментозном) гепатите и относятся к коагуляционным процессам. Перед развитием коагуляционного некроза происходит стадия ацидофильной дистрофии. В этом случае гепатоциты уменьшаются в размере, словно сморщиваются, и у них наблюдается плотная однородная цитоплазма с пикнотическими ядрами. Форма гепатоцитов теряется, а их контуры представляют собой изломанную линию.
Гепатоциты подвергаются "мумификации" и выбрасываются в синусоиды. Тонкие некротизированные гепатоциты называют тельцами Каунсильмена, которые могут иметь различные размеры, ярко окрашенную эозином цитоплазму и сморщенные ядра, оттеснённые к периферии с неровными границами, приобретающими часто форму полулуния. Тельца Кальмена находятся во всех отделах дольки. Нередко их окружают дендритные ретикулоэндотелиоциты. Подобная клиническая картина обозначается как "саттелиоз" и наблюдается при гепатите В.
- Моноцеллюлярный колликвационный некроз
Это завершение баллонной дистрофии. В данном случае гепатоциты не выбрасываются в синусоиды, а умирают, оставаясь в печеночной пластинке. Такой процесс чаще всего наблюдается в третьей зоне ацинуса. Явления колликвационного некрозаCells не так просто увидеть — некротизированные гепатоциты быстро уничтожаются макрофагами.
Наличие этих клеток может служить индикатором некроза, даже если в образцах не осталось самих некротизированных элементов. Скопления макрофагов могут образовывать гранулемы. Косвенным признаком некроза можно считать очаговый коллапс стромы, который выявляется на препаратах, обработанных серебром, а также окрашенных по методам Ван Гизона и орсеином.
Это некрозы небольших групп клеток печени, расположенных рядом с портальными трактами. Они представляют собой разрушение гепатоцитов на границе между паренхимой и соединительной тканью, сопровождаемся лимфоцитарной (иногда лимфоплазмоцитарной) инфильтрацией. Данные изменения наблюдаются при хроническом гепатите с высокой активностью, остром вирусном гепатите, первичном билиарном циррозе, первичном склерозирующем холангите, болезни Вильсона-Коновалова и циррозе печени. К ступенчатым некрозам относятся не только перипортальные, но и перисептальные некрозы, которые находятся в области соединительнотканных септ (как правило, активных). В гистологических образцах при ступенчатом некрозе (так же, как и при мостовидных) некротизированные гепатоциты, как правило, не являются видимыми.
При оценке ступенчатых некрозов важным является не отсутствие гепатоцитов в областях, прилегающих к портальным трактам или септам, а замещение этих зон лимфоидно-клеточным инфильтратом, где ранее находились гепатоциты, не подвергшиеся некрозу. В данной области можно выявить «замурованные» отдельно располагающиеся практически неизмененные гепатоциты или их небольшие скопления. С увеличением активности процесса возрастает количество мононуклеарных фагоцитов, взаимодействующих с печеночными клетками. Мононуклеарные клетки могут оказывать прямое воздействие на гепатоциты, однако механизм такого влияния остаётся неясным. Возможно, здесь имеет место непосредственное воздействие протеолитических ферментов и лимфокинов, вырабатываемых Т-лимфоцитами, на гепатоциты.
Развитие некрозов при хроническом гепатите с выраженной активностью объясняют клеточноопосредованным цитотоксическим механизмом путем проникновения лимфоцитов в структуру гепатоцита (эмпириополез). Лимфоциты могут находиться как по периферии клетки, так и вблизи ядра. При хроническом гепатите с выраженной активностью в биоптатах печени имеется более 10 клеток с признаками агрессивного эмпириополеза в окружности шести портальных трактов, при гепатите с минимальной активностью их менее десяти. Обнаружение агрессивности эмпириополеза при хроническом гепатите имеет диагностическое значение, свидетельствует о прогрес-сировании заболевания.
Развитие некротических изменений приводит к образованию соединений между различными зонами ацинусов посредством некротических мостиков. Мостовидный некроз играет важную роль в прогнозировании как острого, так и хронического гепатита. Он является характерным признаком всех форм некроза, сопровождающихся соединением сосудистых структур печени.
Данное определение также охватывает некроз целых долек, который называют мульти-лобулярным. В зависимости от расположения различают несколько типов мостовидных некрозов: центроцентральные, центропортальные и портопортальные. Неблагоприятным является сочетание ступенчатых и портоцентральных некрозов.
Мостовидный некроз разрушает дольку, что способствует последующему развитию цирроза. Процесс некроза завершается формированием септ, содержащих сосудистые структуры, которые перенаправляют портальную кровь прямо в печеночную вену, обходя систему синусоидов. Это вызывает частичную ишемию паренхиматозной ткани, что негативно сказывается на ее регенерации и приводит к тому, что портальная кровь, минуя печеночный фильтр, попадает в общий кровоток.
Симптоматика некроза печени:
Отличается быстрым развитием болевого синдрома и диспептических проявлений, однако у отдельных пациентов заболевание может проявляться более медленно.
Наиболее распространенный желтушный вариант: усиливающаяся слабость, отсутствие аппетита, тошнота, рвота, желтуха, понос, резкое уменьшение массы тела. Болевые ощущения локализуются в правом подреберье и области желудка. Возможно лихорадка.
В процессе обследования обнаруживаются желтуха, увеличенная печень и высокая температура. При пальпации печень оказывается болезненной и гладкой. У пациентов также происходит увеличение селезенки, наблюдается ладонный рубероид (эритема), сосудистые звездочки на коже и тремор рук (астериксис), что говорит о наличии печеночной энцефалопатии. Наблюдаются изменения психики (заторможенность, возбужденное состояние, галлюцинации), а также асцит, который не поддается воздействию диуретиков.
Редко встречается холестатический вариант, сопровождающийся зудом кожи, обесцвеченным стулом и темной мочой. В анализах крови фиксируется выраженная гипербилирубинемия, повышенный уровень холестерина, а также увеличение активности щелочной фосфатазы, гаммаглютамилтранспептидазы и умеренное повышение AST и ALT.
Лечение Некроза печени:
Основной задачей в лечении различных форм некроза является устранение причины, вызвавшей это состояние: предотвращение дальнейшего воздействия травмирующего фактора, проведение антибактериальной, дезинтоксикационной и десенсибилизирующей терапии, нормализация работы сердца, восстановление проходимости сосудов или восстановление их целостности, а также устранение сжатия и повреждений нервов, спинного мозга и других структур.
Элементами комплексного лечения являются улучшение общего состояния больного, стимулирование иммунобиологических сил и регенеративных свойств, симптоматическая терапия.
Некрэктомия, представляющая собой удаление мёртвых тканей, осуществляется в области здоровых тканей в момент появления демаркационной линии или после уточнения границ некроза с помощью механического воздействия (например, укол иглой от шприца, прикосновение хирургическим инструментом, шариком и т.д.). Образовавшуюся после некрэктомии рану закрывают с помощью швов или дерматопластики.
Лечение некроза печени
Пациенты с острым некрозом печени лечатся в условиях отделения интенсивной терапии. Основное внимание уделяется ликвидации печеночной недостаточности. В реанимационном отделении осуществляется постоянный мониторинг жизненно важных функций, концентрации глюкозы, азотистых шлаков и электролитов.
Для предотвращения кровотечений ежедневно вводят витамин К внутривенно. Переливание коагуляционных факторов в профилактических целях не требуется. Кроме того, обязательно назначаются препараты, снижающие выработку соляной кислоты в желудке. При появлении судорог применяется диазепам. В случае тяжелого течения некроза печени может понадобиться переход на полное парентеральное питание.
Улучшение функций почек может быть достигнуто лишь при условии восстановления работы печени. Процедуры диализа или гемосорбции при этой патологии зачастую сопровождаются серьезными кровотечениями и распространением инфекций, поэтому терапия должна сосредоточиться на восстановлении функций печени.
Ухудшение состояния печеночной энцефалопатии в случае некроза печени может быть спровоцировано попаданием азотистых соединений в желудочно-кишечный тракт. Эти вещества расщепляются микрофлорой кишечника, и их метаболиты попадают в кровь, вызывая повреждения головного мозга. Для терапии печеночной энцефалопатии пациентам назначают парентеральное питание с аминокислотами, а также приема антибактериальных препаратов (например, неомицин, метронидазол) для подавления микрофлоры кишечника, а также лактулозу.
На данный момент ни один из существующих способов, призванных заменить функции печени, не демонстрирует высокой эффективности. Среди этих методов (заменяющее переливание крови, плазмаферез, диализ, гемосорбция) гемосорбция с использованием активированного угля и поддержкой простациклином (для предотвращения агрегации тромбоцитов) считается полезной в некоторых случаях.
Если внезапно развивается энцефалопатия, отек мозга и лечение не приносит результатов в течение 24 часов, единственным способом спасти жизнь пациента может стать трансплантация печени. Однако провести такую операцию в столь короткие сроки бывает довольно трудно, а выживаемость после нее у больных с сверхострым некрозом печени не превышает 65% в течение первого года.
Прогноз и профилактика некроза печени
Прогноз при печёночном некрозе зависит от множества факторов: возраста пациента, причины заболевания, продолжительности энцефалопатии и комы, тяжести полиорганной недостаточности, наличия инфекционных осложнений и других обстоятельств. Негативные прогнозы при некрозе печени наблюдаются при следующих условиях: возраст до 10 лет или старше 40 лет; выраженный метаболический ацидоз; длительная желтуха, сохраняющаяся более недели до начала энцефалопатии; уровень общего билирубина свыше 300 мкмоль/л. Смерть при некрозе печени может быть вызвана неврологическими расстройствами, желудочно-кишечными кровотечениями, сепсисом, нарушениями жизненно важных функций (дыхания и кровообращения), а также почечной недостаточностью. У пациентов, которые выжили, функция печени может восстановиться полностью или частично, что в случае частичного восстановления приводит к развитию постнекротического цирроза.
